Reakcje odwracalne i nieodwracalne - Hipermarket Wiedzy. Odwracalność reakcji chemicznych. Równowaga chemiczna Reakcje odwracalne, koncepcja równowagi chemicznej
Wszystkie reakcje chemiczne można podzielić na dwie grupy: nieodwracalne i odwracalne reakcje. Nieodwracalne reakcje przejść do końca (aż do całkowitego zużycia jednego z odczynników) i in odwracalnyŻaden z reagentów nie ulega całkowitemu zużyciu, ponieważ odwracalna reakcja może zachodzić zarówno w kierunku do przodu, jak i do tyłu.
Przykład nieodwracalnej reakcji:
Zn + 4HNO 3 → Zn(NO 3) 2 + 2NO 2 + 2H 2 O
Przykład reakcji odwracalnej:
Początkowo szybkość reakcji do przodu w pr jest wysoki, a szybkość reakcji odwrotnej w mniej więcej równe zeru
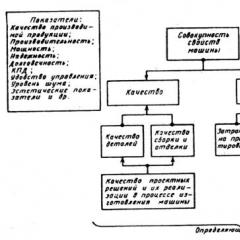
 | Zależność szybkości reakcji do przodu i do tyłu od czasu τ. Kiedy te szybkości są równe, zachodzi równowaga chemiczna. |
W miarę postępu reakcji substancje wyjściowe ulegają zużyciu, a ich stężenie spada. Jednocześnie pojawiają się produkty reakcji i wzrasta ich stężenie. W rezultacie zaczyna zachodzić reakcja odwrotna, a jej prędkość stopniowo wzrasta. Gdy szybkości reakcji do przodu i do tyłu zrównają się, zachodzi równowaga chemiczna. Ma charakter dynamiczny, ponieważ chociaż stężenia substancji w układzie pozostają stałe, reakcja nadal zachodzi zarówno w kierunku do przodu, jak i do tyłu.
Jeśli istnieje równość w Na w możemy zrównać ich wyrazy zgodnie z prawem akcji masowej*. Na przykład dla odwracalnego oddziaływania wodoru z jodem:
k pr ··= k obr. · 2 lub

Postawa stałe szybkości reakcji w przód i w tył (K) nazywa się stałą równowagi. W stałej temperaturze stała równowagi jest stałą wartością pokazującą zależność pomiędzy stężeniami produktów i substancji wyjściowych, która ustala się w równowadze. Ogrom K zależy od charakteru reagentów i temperatury.
Układ znajduje się w stanie równowagi, dopóki warunki zewnętrzne pozostają niezmienne. Gdy wzrasta stężenie którejkolwiek z substancji biorących udział w reakcji, równowaga przesuwa się w stronę zużycia tej substancji; Kiedy stężenie jakiejkolwiek substancji maleje, równowaga przesuwa się w kierunku tworzenia tej substancji.
Wśród licznych klasyfikacji typów reakcji, np. tych, które zależą od efektu termicznego (egzotermicznego i endotermicznego), od zmian stopnia utlenienia substancji (redoks), od liczby składników biorących w nich udział (rozkład, związki) i tak dalej, reakcje zachodzące w dwóch wzajemnych kierunkach, zwane inaczej odwracalny . Alternatywą dla reakcji odwracalnych są reakcje nieodwracalny, podczas którego powstaje produkt końcowy (osad, substancja gazowa, woda). Wśród tych reakcji są następujące:
Reakcje wymiany pomiędzy roztworami soli, podczas których tworzy się nierozpuszczalny osad - CaCO 3:
Ca(OH) 2 + K 2 CO 3 → CaCO3↓ + 2KON (1)
lub substancja gazowa - CO 2:
3 K 2 CO 3 + 2H 3 RO 4 →2K 3 RO 4 + 3 CO2+ 3H 2O (2)
lub otrzymuje się substancję lekko dysocjującą - H 2 O:
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2 H 2O(3)
Jeśli weźmiemy pod uwagę reakcję odwracalną, to przebiega ona nie tylko w kierunku do przodu (w reakcjach 1,2,3 od lewej do prawej), ale także w kierunku przeciwnym. Przykładem takiej reakcji jest synteza amoniaku z substancji gazowych - wodoru i azotu:
3H 2 + N 2 ↔ 2NH 3 (4)
Zatem, reakcję chemiczną nazywamy odwracalną, jeśli przebiega nie tylko w kierunku do przodu (→), ale także w kierunku odwrotnym (←) i jest oznaczony symbolem (↔).
Główną cechą tego typu reakcji jest to, że z substancji wyjściowych powstają produkty reakcji, ale jednocześnie z tych samych produktów powstają odczynniki wyjściowe. Jeśli weźmiemy pod uwagę reakcję (4), to we względnej jednostce czasu, jednocześnie z utworzeniem dwóch moli amoniaku, nastąpi ich rozkład z utworzeniem trzech moli wodoru i jednego mola azotu. Oznaczmy szybkość reakcji bezpośredniej (4) symbolem V 1, wówczas wyrażenie na tę szybkość będzie miało postać:
V 1 = kˑ [Н 2 ] 3 ˑ , (5)
gdzie wartość „k” definiuje się jako stałą szybkości danej reakcji, wartości [H 2 ] 3 odpowiadają stężeniom substancji wyjściowych podniesionym do potęg odpowiadających współczynnikom w równaniu reakcji. Zgodnie z zasadą odwracalności szybkość reakcji odwrotnej przyjmie wyrażenie:
V 2 = kˑ 2 (6)
W początkowej chwili szybkość reakcji do przodu przyjmuje największą wartość. Stopniowo jednak stężenia odczynników wyjściowych maleją i szybkość reakcji maleje. Jednocześnie szybkość reakcji odwrotnej zaczyna rosnąć. Kiedy szybkości reakcji do przodu i do tyłu stają się takie same (V 1 = V 2), stan równowagi , przy którym nie następuje już zmiana stężeń zarówno początkowych, jak i powstałych odczynników.
Należy zauważyć, że niektórych nieodwracalnych reakcji nie należy rozumieć dosłownie. Podajmy przykład najczęściej cytowanej reakcji metalu z kwasem, w szczególności cynku z kwasem solnym:
Zn + 2HCl = ZnCl2 + H2 (7)
W rzeczywistości cynk rozpuszczony w kwasie tworzy sól: chlorek cynku i gazowy wodór, ale po pewnym czasie szybkość reakcji bezpośredniej maleje wraz ze wzrostem stężenia soli w roztworze. Gdy reakcja praktycznie się zakończy, w roztworze będzie obecna pewna ilość kwasu solnego wraz z chlorkiem cynku, dlatego reakcję (7) należy przedstawić w postaci:
2Zn + 2HCl = 2Zn·Cl + H2 (8)
Lub w przypadku powstania nierozpuszczalnego osadu otrzymanego przez połączenie roztworów Na2SO4 i BaCl2:
Na 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2NaCl (9)
wytrącona sól BaSO 4, choć w niewielkim stopniu, będzie dysocjować na jony:
BaSO 4 ↔ Ba 2+ + SO 4 2- (10)
Dlatego pojęcia reakcji nieodwracalnych i nieodwracalnych są względne. Niemniej jednak, zarówno w przyrodzie, jak iw praktycznych działaniach ludzi, reakcje te mają ogromne znaczenie. Na przykład procesy spalania węglowodorów lub bardziej złożonych substancji organicznych, takich jak alkohol:
CH 4 + O 2 = CO 2 + H 2 O (11)
2C 2 H 5 OH + 5O 2 = 4CO 2 + 6H 2 O (12)
są procesami całkowicie nieodwracalnymi. Uznano by to za szczęśliwy sen ludzkości, gdyby reakcje (11) i (12) były odwracalne! Wtedy możliwa byłaby ponowna synteza gazu, benzyny i alkoholu z CO 2 i H 2 O! Natomiast reakcje odwracalne takie jak (4) czyli utlenianie dwutlenku siarki:
SO 2 + O 2 ↔ SO 3 (13)
są zasadowe w produkcji soli amonowych, kwasu azotowego, kwasu siarkowego i innych związków nieorganicznych i organicznych. Ale te reakcje są odwracalne! Natomiast aby otrzymać finalne produkty: NH 3 lub SO 3 konieczne jest zastosowanie takich metod technologicznych jak: zmiana stężeń odczynników, zmiana ciśnienia, podwyższenie lub obniżenie temperatury. Ale to będzie już tematem następnego tematu: „Przesunięcie równowagi chemicznej”.
blog.site, przy kopiowaniu materiału w całości lub w części wymagany jest link do oryginalnego źródła.
Reakcje chemiczne ze względu na odwracalność dzielimy na nieodwracalne i odwracalne. Reakcje nieodwracalne obejmują te reakcje, które trwają do całkowitego zużycia jednego z reagentów. Oznakami nieodwracalnych reakcji zachodzących w roztworach są: a) wytrącanie się, b) tworzenie się gazu, c) tworzenie się słabego elektrolitu.
Reakcje odwracalne to reakcje, które zachodzą jednocześnie w dwóch wzajemnie przeciwnych kierunkach. W przypadku takich reakcji zamiast znaku równości stosuje się przeciwne strzałki (-).
Z biegiem czasu szybkość dowolnej reakcji, mierzona malejącymi stężeniami substancji wyjściowych, będzie się zmniejszać, ponieważ w miarę interakcji substancji ich stężenia maleją (szybkość reakcji bezpośredniej). Jeśli reakcja jest odwracalna, to wraz ze wzrostem stężenia produktów jej prędkość będzie wzrastać (szybkość reakcji odwrotnej). Gdy tylko szybkości reakcji do przodu i do tyłu zrównają się, w układzie ustala się równowaga chemiczna i dalsze zmiany stężeń wszystkich substancji w układzie ustają.
Ilościową cechą stanu równowagi jest stała równowagi chemicznej K, która jest określona przez stosunek stałych szybkości reakcji do przodu i do tyłu
W zdecydowanej większości przypadków stałe szybkości reakcji do przodu i do tyłu nie są równe. Stała równowagi jest wartością stałą w danej temperaturze i określa zależność pomiędzy stężeniami równowagowymi produktów reakcji i substancji wyjściowych, podniesionymi do potęgi ich współczynników stechiometrycznych. Na przykład dla procesu

Nawias kwadratowy wskazuje stężenie każdej substancji w momencie równowagi, tzw. stężenie równowagowe.
Stała równowagi zależy od rodzaju reagentów i temperatury. Katalizator nie wpływa na stan równowagi. Obecność katalizatora w układzie zmienia jedynie czas dotarcia do niego. Układ może pozostawać w stanie równowagi do czasu zmiany przynajmniej jednego z czynników zewnętrznych: temperatury, stężenia jednego z odczynników, ciśnienia (w przypadku gazów). Zmiany zachodzące w układzie równowagi pod wpływem wpływów zewnętrznych określa zasada poruszającej się równowagi (prawo Le Chateliera): oddziaływanie zewnętrzne na układ będący w stanie równowagi prowadzi do przesunięcia tej równowagi w kierunku, w którym efekt wytworzonego efektu jest osłabiony.
Na zmianę równowagi wpływają:
- 1) zmiana temperatury: proces endotermiczny przyspiesza w większym stopniu wraz ze wzrostem temperatury i odwrotnie, wraz ze spadkiem temperatury proces egzotermiczny przyspiesza;
- 2) zmiana ciśnienia (dla reakcji zachodzących w fazie gazowej): wraz ze wzrostem ciśnienia równowaga reakcji przesuwa się w kierunku powstawania substancji zajmujących mniejszą objętość i odwrotnie, spadek ciśnienia sprzyja procesowi, któremu towarzyszy wzrost objętości. Jeżeli reakcja przebiega bez zmiany objętości, to zmiana ciśnienia w układzie nie wpływa na równowagę chemiczną.
- 3) zmiana stężenia: wzrost stężenia substancji wyjściowych prowadzi do wzrostu szybkości reakcji przedniej, natomiast proces zachodzący w układzie zakończy się, gdy szybkości reakcji przedniej i odwrotnej zrównają się i pojawi się nowy ustala się równowaga. Zmniejszenie stężenia jednego z produktów reakcji (usunięcie z układu) prowadzi do przesunięcia równowagi w stronę jego powstania.
Tematy kodyfikatorów: reakcje odwracalne i nieodwracalne. Bilans chemiczny. Przesunięcie równowagi chemicznej pod wpływem różnych czynników.
Jeśli możliwa jest reakcja odwrotna, reakcje chemiczne dzielimy na odwracalne i nieodwracalne.
Odwracalne reakcje chemiczne - są to reakcje, których produkty w danych warunkach mogą ze sobą oddziaływać.
Na przykład, synteza amoniaku jest reakcją odwracalną:
N2 + 3H2 = 2NH3
Proces odbywa się w wysokiej temperaturze, pod ciśnieniem i w obecności katalizatora (żelaza). Procesy takie są zwykle odwracalne.
Nieodwracalne reakcje - są to reakcje, których produkty nie mogą ze sobą oddziaływać w danych warunkach.
Na przykład, reakcje spalania lub reakcje zachodzące podczas eksplozji są najczęściej nieodwracalne. Postępuje spalanie węgla nieodwracalnie:
C + O2 = CO2
Więcej szczegółów dot klasyfikacja reakcji chemicznych można przeczytać.
Prawdopodobieństwo interakcji produktu zależy od warunków procesu.
Jeśli więc system otwarty, tj. wymienia zarówno materię, jak i energię z otoczeniem, wówczas reakcje chemiczne, w wyniku których powstają np. gazy, będą nieodwracalne.
Na przykład , podczas kalcynacji stałego wodorowęglanu sodu:
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
Uwalnia się gazowy dwutlenek węgla, który odparowuje ze strefy reakcji. Dlatego ta reakcja będzie nieodwracalny pod tymi warunkami.
Jeśli weźmiemy pod uwagę zamknięty system , Który Nie mogę wymienić substancję z otoczeniem (np. zamkniętą skrzynię, w której zachodzi reakcja), wówczas dwutlenek węgla nie będzie mógł wydostać się ze strefy reakcji, a będzie oddziaływać z wodą i węglanem sodu, wówczas reakcja będzie odwracalna w warunkach te warunki:
2NaHCO 3 ⇔ Na 2 CO 3 + CO 2 + H 2 O
Rozważmy reakcje odwracalne. Niech reakcja odwracalna przebiega według schematu:
aA + bB ⇔ cC + dD
Szybkość reakcji bezpośredniej zgodnie z prawem działania mas określa wyrażenie:
v 1 =k 1 ·C A a ·C B b
Szybkość sprzężenia zwrotnego:
v 2 =k 2 ·C с ·C re re
Tutaj k 1 I k 2 są stałymi szybkości odpowiednio reakcji do przodu i do tyłu, C A, C B, C C, C D– stężenia odpowiednio substancji A, B, C i D.
Jeżeli w początkowym momencie reakcji w układzie nie ma substancji C i D, wówczas cząstki A i B zderzają się i oddziałują głównie i zachodzi przeważnie reakcja bezpośrednia.
Stopniowo stężenie cząstek C i D również zacznie rosnąć, dlatego wzrośnie szybkość reakcji odwrotnej. W pewnym momencie szybkość reakcji w przód będzie równa szybkości reakcji odwrotnej. Ten stan nazywa się równowaga chemiczna .
Zatem, równowaga chemiczna to stan układu, w którym szybkości reakcji w przód i w tył są równe .
Ponieważ szybkości reakcji do przodu i do tyłu są równe, szybkość tworzenia odczynników jest równa szybkości ich zużycia, a prąd stężenia substancji nie ulegają zmianie
. Takie stężenia nazywane są równowaga
.
Należy pamiętać, że w równowadze Występują zarówno reakcje do przodu, jak i do tyłu, to znaczy reagenty oddziałują ze sobą, ale produkty również oddziałują ze sobą w tym samym tempie. Jednocześnie czynniki zewnętrzne mogą mieć wpływ wypierać równowaga chemiczna w tym czy innym kierunku. Dlatego równowaga chemiczna nazywa się mobilny, Lub dynamiczny .

Badania w dziedzinie równowagi ruchomej rozpoczęły się w XIX wieku. Prace Henriego Le Chateliera położyły podwaliny pod teorię, którą później uogólnił naukowiec Karl Brown. Zasada równowagi ruchomej, czyli zasada Le Chateliera-Browna, stwierdza:
Jeżeli na układ będący w stanie równowagi oddziałuje czynnik zewnętrzny zmieniający którykolwiek z warunków równowagi, wówczas nasilają się w układzie procesy mające na celu kompensację wpływu zewnętrznego.
Innymi słowy: Kiedy na system wywierany jest wpływ zewnętrzny, równowaga przesunie się, aby zrekompensować ten wpływ zewnętrzny.
Zasada ta, bardzo ważna, działa w przypadku wszelkich zjawisk równowagowych (nie tylko reakcji chemicznych). Jednak teraz rozważymy to w odniesieniu do interakcji chemicznych. W przypadku reakcji chemicznych wpływy zewnętrzne prowadzą do zmian stężeń równowagowych substancji.
Na reakcje chemiczne w stanie równowagi mogą wpływać trzy główne czynniki: temperatura, ciśnienie i stężenie reagentów lub produktów.
1. Jak wiadomo, reakcjom chemicznym towarzyszy efekt termiczny. Jeśli bezpośrednia reakcja zachodzi wraz z uwolnieniem ciepła (egzotermiczna lub +Q), to reakcja odwrotna zachodzi wraz z absorpcją ciepła (endotermiczna lub -Q) i odwrotnie. Jeśli podbijesz temperatura w systemie równowaga przesunie się tak, aby skompensować ten wzrost. Logiczne jest, że w reakcji egzotermicznej nie można kompensować wzrostu temperatury. Zatem wraz ze wzrostem temperatury równowaga w układzie przesuwa się w kierunku absorpcji ciepła, tj. w kierunku reakcji endotermicznych (-Q); wraz ze spadkiem temperatury - w kierunku reakcji egzotermicznej (+Q).
2. W przypadku reakcji równowagowych, gdy przynajmniej jedna z substancji znajduje się w fazie gazowej, na równowagę znacząco wpływa również zmiana ciśnienie w systemie. Wraz ze wzrostem ciśnienia układ chemiczny stara się zrekompensować ten efekt i zwiększa szybkość reakcji, w wyniku której zmniejsza się ilość substancji gazowych. Wraz ze spadkiem ciśnienia układ zwiększa szybkość reakcji, w wyniku której powstaje więcej cząsteczek substancji gazowych. Zatem: wraz ze wzrostem ciśnienia równowaga przesuwa się w kierunku zmniejszenia liczby cząsteczek gazu, a wraz ze spadkiem ciśnienia - w kierunku wzrostu liczby cząsteczek gazu.
Notatka! Na układy, w których liczba cząsteczek reagentów i produktów jest taka sama, ciśnienie nie ma wpływu! Również zmiany ciśnienia praktycznie nie mają wpływu na równowagę roztworów, tj. w reakcjach, w których nie ma gazów.
3. Zmiany wpływają również na równowagę w układach chemicznych stężenia reagenty i produkty. W miarę wzrostu stężenia reagentów system stara się je wykorzystać i zwiększa szybkość reakcji do przodu. Gdy stężenie odczynników maleje, system próbuje je wytworzyć, a szybkość reakcji odwrotnej wzrasta. Wraz ze wzrostem stężenia produktów system również próbuje je skonsumować i zwiększa szybkość reakcji odwrotnej. Kiedy stężenie produktów maleje, układ chemiczny zwiększa szybkość ich powstawania, tj. szybkość reakcji naprzód.
Jeśli w układzie chemicznym wzrasta szybkość reakcji do przodu Prawidłowy , w kierunku tworzenia produktów I zużycie odczynnika . Jeśli wzrasta szybkość reakcji odwrotnej, mówimy, że równowaga się przesunęła lewy , w stronę konsumpcji żywności I zwiększenie stężenia odczynników .
Na przykład, w reakcji syntezy amoniaku:
N 2 + 3H 2 = 2NH 3 + Q
Wzrost ciśnienia prowadzi do wzrostu szybkości reakcji, w wyniku której powstaje mniej cząsteczek gazu, tj. reakcja bezpośrednia (liczba cząsteczek gazów reagentów wynosi 4, liczba cząsteczek gazu w produktach wynosi 2). Wraz ze wzrostem ciśnienia równowaga przesuwa się w prawo, w stronę produktów. Na wzrost temperatury równowaga się przesunie w kierunku przeciwnym do reakcji endotermicznej, tj. w lewo, w stronę odczynników. Wzrost stężenia azotu lub wodoru przesunie równowagę w stronę ich zużycia, czyli tzw. w prawo, w stronę produktów.
Katalizator nie wpływa na równowagę, ponieważ przyspiesza reakcje do przodu i do tyłu.
Samouczek wideo 2: Przesunięcie równowagi chemicznej
Wykład: Odwracalne i nieodwracalne reakcje chemiczne. Bilans chemiczny. Przesunięcie równowagi chemicznej pod wpływem różnych czynników
Odwracalne i nieodwracalne reakcje chemiczne
Z poprzedniej lekcji dowiedziałeś się, jaka jest szybkość reakcji chemicznej i jakie czynniki na nią wpływają. W tej lekcji przyjrzymy się, jak zachodzą te reakcje. Zależy to od zachowania substancji wyjściowych biorących udział w reakcji – odczynników. Jeśli zostaną całkowicie przekształcone w substancje końcowe - produkty, wówczas reakcja jest nieodwracalna. Cóż, jeśli produkty końcowe zostaną przekształcone z powrotem w pierwotne substancje, wówczas reakcja jest odwracalna. Biorąc to pod uwagę, sformułujmy definicje:
Odwracalna reakcja- jest to pewna reakcja zachodząca w tych samych warunkach w kierunku do przodu i do tyłu.
Pamiętaj, że na lekcjach chemii pokazano ci wyraźny przykład odwracalnej reakcji wytwarzania kwasu węglowego:
CO2 + H2O<->H2CO3
Nieodwracalna reakcja- jest to pewna reakcja chemiczna, która przebiega w jednym określonym kierunku.
Przykładem jest reakcja spalania fosforu: 4P + 5O 2 → 2P 2 O 5
Dowodem nieodwracalności reakcji jest tworzenie się osadu lub uwolnienie gazu.
Równowaga chemicznaKiedy szybkości reakcji do przodu i do tyłu są równe, następuje to równowaga chemiczna.
Oznacza to, że w reakcjach odwracalnych powstają równowagowe mieszaniny reagentów i produktów. Zobaczmy na przykładzie, jak tworzy się równowaga chemiczna. Weźmy reakcję tworzenia jodowodoru:
H 2 (g) + I 2 (g)<->2HI(g)
 Możemy podgrzać mieszaninę gazowego wodoru i jodu lub gotowy jodowodor, wynik w obu przypadkach będzie taki sam: utworzenie równowagowej mieszaniny trzech substancji H 2, I 2, HI.
Możemy podgrzać mieszaninę gazowego wodoru i jodu lub gotowy jodowodor, wynik w obu przypadkach będzie taki sam: utworzenie równowagowej mieszaniny trzech substancji H 2, I 2, HI.
Na samym początku reakcji, przed utworzeniem jodowodoru, zachodzi bezpośrednia reakcja z szybkością ( w itp.). Wyraźmy to za pomocą równania kinetycznego w pr = k 1, gdzie k 1 jest stałą szybkości reakcji do przodu. Stopniowo tworzy się produkt HI, który w tych samych warunkach zaczyna rozkładać się na H2 i I2. Równanie tego procesu jest następujące: w arr = k 2 2, gdzie w rev – szybkość reakcji odwrotnej, k 2 – stała szybkości reakcji odwrotnej. W momencie, gdy HI wystarczy do wyrównania w Na w zachodzi równowaga chemiczna. Ilość substancji znajdujących się w równowadze, w naszym przypadku są to H 2, I 2 i HI, nie zmienia się w czasie, ale tylko pod warunkiem braku wpływów zewnętrznych. Z powyższego wynika, że równowaga chemiczna jest dynamiczna. W naszej reakcji jodowodór albo powstaje, albo jest zużywany.
Pamiętaj, że zmiana warunków reakcji pozwala przesunąć równowagę w pożądanym kierunku. Jeśli zwiększymy stężenie jodu lub wodoru, to ono wzrośnie w Zatem nastąpi przesunięcie w prawo, powstanie więcej jodowodoru. Jeśli zwiększymy stężenie jodowodoru, to ono wzrośnie w arr, a przesunięcie będzie w lewo. Możemy otrzymać więcej/mniej odczynników i produktów.
Zatem równowaga chemiczna ma tendencję do przeciwstawiania się wpływom zewnętrznym. Dodatek H 2 lub I 2 ostatecznie prowadzi do wzrostu ich zużycia i wzrostu HI. I wzajemnie. Ten proces w nauce nazywa się Zasada Le-Chateliera. Brzmi:
Jeśli na układ będący w stabilnej równowadze wpłynie wpływ z zewnątrz (poprzez zmianę temperatury, ciśnienia lub stężenia), wówczas nastąpi przesunięcie w kierunku procesu, który osłabi ten wpływ.
Pamiętaj, że katalizator nie może przesunąć równowagi. Może jedynie przyspieszyć jego początek.
Przesunięcie równowagi chemicznej pod wpływem różnych czynników
Zmiana stężenia . Powyżej przyjrzeliśmy się, jak ten czynnik przesuwa równowagę w przód lub w przeciwnym kierunku. Jeśli stężenie reagentów wzrasta, równowaga przesuwa się w stronę, w której substancja ta jest zużywana. Jeśli zmniejszysz stężenie, przesunie się ono w stronę, w której powstaje ta substancja. Pamiętaj, że reakcja jest odwracalna, a reagentami mogą być substancje zarówno po prawej, jak i po lewej stronie, w zależności od tego, którą reakcję rozważamy (bezpośrednią lub odwrotną).
WpływT . Jego wzrost powoduje przesunięcie równowagi w kierunku reakcji endotermicznej (- Q) i zmniejszenie w kierunku reakcji egzotermicznej (+ Q). Równania reakcji wskazują efekt termiczny reakcji do przodu. Efekt termiczny reakcji odwrotnej jest odwrotny. Zasada ta ma zastosowanie jedynie w przypadku reakcji z efektem termicznym. Jeżeli jej nie ma, to t nie jest w stanie przesunąć równowagi, lecz jej wzrost przyspieszy proces wyłaniania się równowagi.
Wpływ ciśnienia . Czynnik ten można zastosować w reakcjach z udziałem substancji gazowych. Jeśli liczba moli gazu wynosi zero, nie będzie żadnych zmian. Wraz ze wzrostem ciśnienia równowaga przesuwa się w stronę mniejszych objętości. Wraz ze spadkiem ciśnienia równowaga przesunie się w stronę większych objętości. Objętości - spójrz na współczynniki substancji gazowych w równaniu reakcji.
| | |